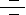香港理工大学团队开发出新型的接骨螺钉
发布时间:2020-01-14 09:38 来源:生物通
编辑推荐:
香港理工大学的研究团队开发出一种可编程的接骨螺钉,可以满足骨骼修复过程中对刚性、生物活性和固定能力的要求。
接骨螺钉是一种常见的固定装置,适用于骨折部位的固定。传统的接骨螺钉材料大多为不锈钢等金属材料,不过它们可能会导致发炎,并表现出不良的骨整合。形状记忆聚合物(SMP)为骨骼愈合开辟了新的领域。这些高分子材料可在变形后固定,并通过外界条件的刺激又恢复其初始形状。
以往人们已经开发出一些低成本的SMP,但这些材料的弹性模量低(易变形),不太适用于骨骼再生。为此,香港理工大学的研究团队开发出一种可编程的接骨螺钉,可以满足骨骼修复过程中对刚性、生物活性和固定能力的要求。这项成果于近日在线发表于《Acta Biomaterialia》上(影响因子:6.638)。
据介绍,这种新型的形状记忆聚合物复合材料(SMPC)由形状记忆聚氨酯(SMPU)、羟基磷灰石(HA)以及精氨酸-甘氨酸-天冬氨酸(RGD)多肽组成,具有良好的固定和成骨特征。选择HA的原因是它与天然骨骼在结构上具有相似性,并具有骨诱导性和骨传导性。RGD多肽可用来修饰复合材料的表面性质,以促进细胞粘附。
SMPC螺钉的组分和工作原理如图1所示:将螺钉在高温下压缩,然后在低温下固定;通过微创手术将编程的螺钉植入骨缺损部位。由于形状记忆效应,螺钉恢复到其原始状态,并为周围组织提供支撑。
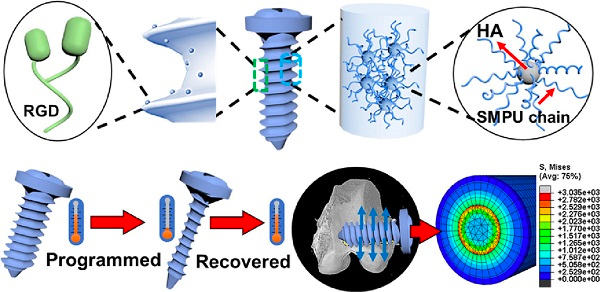
图1. SMPC螺钉的组分和工作原理
在设计出SMPC螺钉后,研究人员鉴定了复合材料的机械和记忆性质。SMP/HA/RGD的模量(~250 MPa)与未修饰的SMP(~118 MPa)相比大大提高,表示这种螺钉不易发生形变。同时,在相同的力负载下,SMPC螺钉的移位比金属螺钉小,这表明SMPC螺钉的固定效果要优于金属螺钉。
他们还测得,SMP/HA/RGD的形状固定率(Rf)约为90%,形状恢复率(Rr)约为96%,表明这种复合材料具有良好的形状恢复功能。Rf对微创治疗非常重要,当Rf较高时,这种记忆螺钉可压缩到很小的尺寸进行植入。在模拟生物学条件下,SMPC螺钉的形状固定率约为80%,形状恢复率约为82%。体外测试结果表明,螺钉可在20秒内迅速恢复到其原始形状,从而轻松实现骨折内固定。
之后,研究人员通过细胞实验分析了SMP及复合材料对细胞活力和增殖的影响。他们将兔间充质干细胞(rMSC)与各种材料一起培养,并检测细胞活力和增殖。结果表明,SMP/HA/RGD组能够很好地支持间充质干细胞的存活和增殖(图2)。同样地,这种复合材料对rMSC的成骨分化也有益处,为体外条件下的细胞生长提供了理想的物质。本研究中的兔间充质干细胞及成骨分化培养基由赛业生物提供。
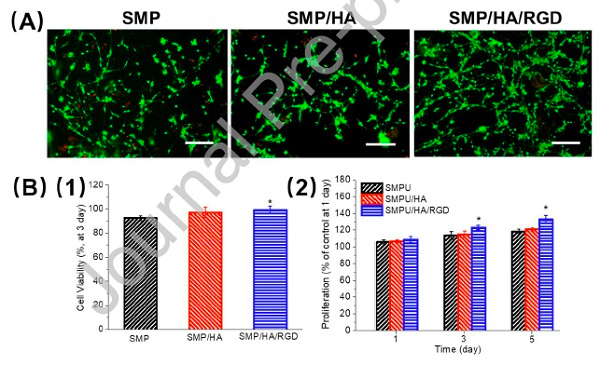
图2. SMP及复合材料对细胞行为的影响
在细胞实验完成后,研究人员接着以新西兰白兔作为研究对象,通过体内实验研究了SMPC螺钉对骨组织生长的作用。12只白兔的双膝存在缺陷,因此总共有24处缺陷。这些缺陷被随机分为两组:实验组用SMPC螺钉治疗,而对照组用市售金属螺钉治疗。植入4周后,金属螺钉周围几乎找不到组织,在8周甚至12周也没有明显改善。相反,SMPC螺钉植入4周后,周围可以清晰观察到组织生长。更重要的是,随着时间的推移,SMPC螺钉与组织之间的融合程度也得到了改善。
为了进一步研究组织相容性,研究人员在植入两种螺钉后制备了组织切片,并开展HE和Masson染色。图3显示了炎性细胞的数量。尽管两个区域的炎性细胞都随着时间推移而减少,但在手术后第4、8和12周,SMPC螺钉修复部位的炎性细胞明显少于金属螺钉。这些结果表明SMPC螺钉有助于减轻体内的炎症反应。
图3. 螺钉植入后的组织学观察:(A) HE染色;(B) Masson染色
更为重要的是,由于形状记忆效应,SMPC螺钉在动物实验中能够促进骨骼组织的生长,并增强缺损骨骼的生物力学性能。有限元分析(FEA)表明,SMPC螺钉具有形状恢复能力,因此具有快速固定、拧紧装配和机械兼容的能力。
研究人员认为,这种复合材料为长期存在的骨修复问题提供了解决方案,并为新一代接骨螺钉的设计和开发奠定了坚实的基础。(生物通 余亮)
原文检索
Yuanchi Zhang , Jinlian Hu , Ruiqi Xie , Yuhe Yang , Jie Cao , Yunhu Tu , Yi Zhang , Tingwu Qin , Xin Zhao , A Programmable, Fast-fixing, Osteo-regenerative, Biomechanically Robust Bone Screw, Acta Biomaterialia (2019), doi: https://doi.org/10.1016/j.actbio.2019.12.017
 关于我们
关于我们