厦门大学王鑫团队发现人科动物特异性基因USP6在人类智力进化中的功能
发布时间:2019-12-19 09:49 来源:生物通
编辑推荐:
研究发现人科动物特异性基因USP6作为一个新的NMDA受体调控因子,可通过去泛素化途径调节NMDA型谷氨酸受体的降解和稳定性,进而调控突触可塑性和学习记忆能力。
人类与其他动物相比的重要区别在于人类拥有高等认知能力,这种能力集中体现在学习记忆和语言表达方面。而高等认知能力的物质基础是人类在进化过程中形成的高度复杂的大脑,人类大脑的特征主要体现在相对脑容量增加、神经元数目增加以及神经元之间丰富的连接。
基因的进化对大脑进化起着重要作用,人类在进化过程中所产生的ARHGAP11B、TBC1D3、TMEM14B、NOTCH2NL和SRGAP2C等新基因[1-6]参与人类大脑皮层的发育,通常认为这些基因与人类脑进化密切相关。但是遗传因素如何影响人类突触功能和智力进化目前仍不清楚。因此,对进化过程中所产生的新基因或者新的功能性突变进行探索有助于理解人类脑进化的机制。
2019年12月16日,厦门大学神经科学研究所王鑫教授团队在PLOS Biology杂志上发表题为The deubiquitinase USP6 affects memory and synaptic plasticity through modulating NMDA receptor stability的研究,发现人科动物特异性基因USP6作为一个新的NMDA受体调控因子,可通过去泛素化途径调节NMDA型谷氨酸受体的降解和稳定性,进而调控突触可塑性和学习记忆能力。

USP6基因大约于1200万年前因基因组重排产生,仅存在于红毛猩猩、大猩猩、黑猩猩、倭黑猩猩和人类基因组中(图一)[7]。USP6基因编码的蛋白为去泛素化蛋白酶家族成员,其包含两个结构域,分别与USP32和TBC1D3两个基因高度同源,是由这两个基因经染色体重排拼接形成的。已有临床病例报道,因染色体重组错误导致USP6基因片段缺失的患者表现出智力和语言障碍[7, 8]。

图一USP6基因进化示意图。USP6及其同源基因TBC1D3形成于约1.2-1.6千万年前,是一种人科动物特有的基因。USP6基因由TBC1D3的5’端序列和USP32的3’端序列拼合而成。
首先,该研究团队在人脑组织中对USP6的表达进行了检测,发现其在成年人脑中的表达量高于胎脑。接着,研究人员构建了神经元特异性表达USP6的转基因小鼠模型,并发现转基因小鼠表现出增强的学习记忆能力,深入研究表明USP6可通过调节NMDA受体的功能从而提高小鼠海马突触可塑性。研究人员继而对USP6转基因小鼠大脑皮层进行泛素化蛋白组学分析,发现了USP6可以调控多个突触蛋白的泛素化水平,其中包括NMDA受体。进一步研究证实USP6是一个新的NMDA受体的去泛素化酶,其特异性增强NMDA受体的表达和功能,而对AMPA受体表达和功能则没有显著影响。研究人员进一步发现,在人胚胎干细胞诱导的神经元中敲低USP6会影响NMDA受体表达并引起突触功能损伤。综上,USP6可通过去泛素化途径维持NMDA受体的稳定性,从而增强突触可塑性和认知功能(图二)。作为一个人科动物特异基因,USP6可能在人类智力进化过程中发挥着关键作用。
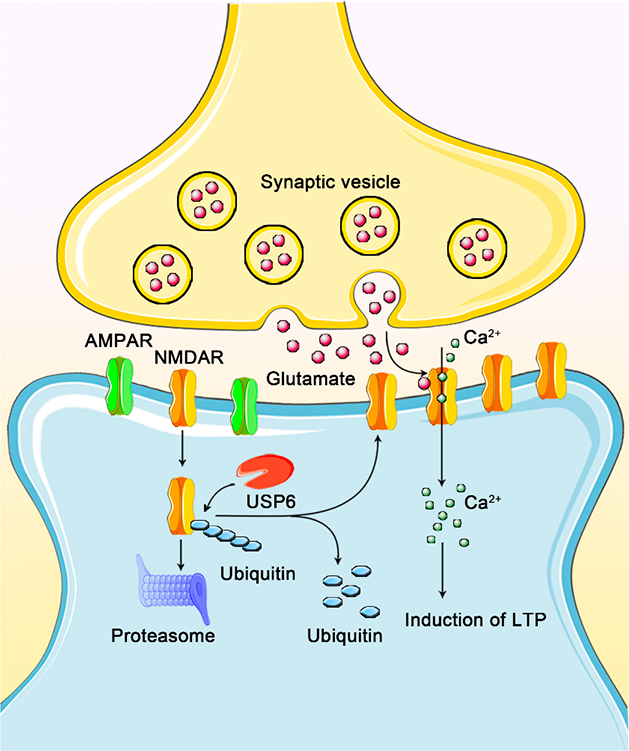
图二USP6功能示意图。USP6是一个去泛素化蛋白酶,在突触后膜通过调控NMDA受体泛素化维持受体的稳定性,从而增强突触可塑性。
厦门大学博士生曾凡伟、马学海与硕士生朱琳为共同第一作者,王鑫教授为通讯作者。该研究得到了国家自然科学基金面上项目和优秀青年基金项目的支持。
参考文献:
1. Florio, M., et al., Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science, 2015. 347(6229): p. 1465-70.
2. Ju, X.C., et al., The hominoid-specific gene TBC1D3 promotes generation of basal neural progenitors and induces cortical folding in mice. Elife, 2016. 5.
3. Liu, J., et al., The Primate-Specific Gene TMEM14B Marks Outer Radial Glia Cells and Promotes Cortical Expansion and Folding. Cell Stem Cell, 2017. 21(5): p. 635-649 e8.
4. Fiddes, I.T., et al., Human-Specific NOTCH2NL Genes Affect Notch Signaling and Cortical Neurogenesis. Cell, 2018. 173(6): p. 1356-1369 e22.
5. Suzuki, I.K., et al., Human-Specific NOTCH2NL Genes Expand Cortical Neurogenesis through Delta/Notch Regulation. Cell, 2018. 173(6): p. 1370-1384 e16.
6. Charrier, C., et al., Inhibition of SRGAP2 function by its human-specific paralogs induces neoteny during spine maturation. Cell, 2012. 149(4): p. 923-35.
7. Paulding, C.A., M. Ruvolo, and D.A. Haber, The Tre2 (USP6) oncogene is a hominoid-specific gene. Proc Natl Acad Sci U S A, 2003. 100(5): p. 2507-11.
8. Ou, Z., et al., Evidence for involvement of TRE-2 (USP6) oncogene, low-copy repeat and acrocentric heterochromatin in two families with chromosomal translocations. Hum Genet, 2006. 120(2): p. 227-37.
 关于我们
关于我们